Шабанова Н.Б., Геращенко А.Д., Ефремова М.П.
Влияние производного пиримидина и кавинтона на изменение биоэлектрического потенциала головного мозга в условиях фокальной церебральной ишемии крыс
Ключевые слова:
фокальная ишемия мозга, биоэлектрический потенциал, кавинтон, производные пиримидина
Острые нарушения церебральной гемодинамики приводят к развитию социально и демографически значимых заболеваний, что является одной из основных проблем здравоохранения, требующих рационального фармакологического подхода.
В патогенезе патологий мозгового кровообращения помимо снижения уровня кровотока немаловажную роль играет нарушение биоэлектрической активности тканей головного мозга, о которой свидетельствуют изменения частоты и амплитуды колебаний на энцефалограмме.
Производные пиримидина ранее зарекомендовали себя как потенциальные церебропротекторы, вследствие чего рассматривались нами в качестве средств, способных скорректировать нарушения электроэнцефалограммы в ишемизированных мозговых тканях.
В связи с этим целью данной работы явилось изучение влияния производного пиримидина и кавинтона на изменение биоэлектрического потенциала в условиях фокальной церебральной ишемии крыс.
Материалы и методы.
Исследование проводилось на 40 крысах-самцах линии Wistar (m = 220–220 г).
Фокальную ишемию головного мозга крыс воспроизводили окклюзией левой средней мозговой артерии.
Животных разделили на 4 равные группы, всем группам, кроме первой, моделировали патологию под хлоралгидратным наркозом (350 мг/кг).
Первая группа – ложнооперированные крысы, вторая – особи негативного контроля.
Третьей и четвертой группам в течение 3 суток после операции вводили референтный препарат кавинтон (3,2 мг/кг) и производное пиримидина PIR-10 (50 мг/кг).
Электрическую активность головного мозга крыс (дельта-, тета-, альфа-, высокачастотный бета-диапазон в лобной и теменной долях левого полушария) оценивали через 3-е суток методом электроэнцефалографии (ЭЭГ) с помощью энцефалографа «Нейрон-спектр 1» (Нейрософт, Россия).
Статистическую обработку проводили с помощью пакета прикладных программ STATISTICA 8.0 (StatSoft, Inc., США).
Результаты исследования.
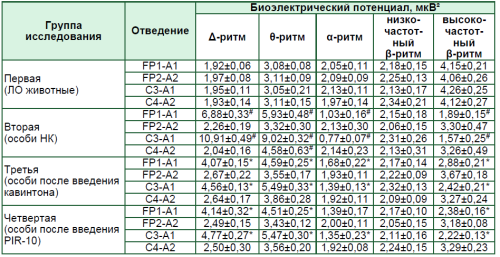
У крыс группы негативного контроля наблюдалось выраженное ухудшение биоэлектрического потенциала, что отмечалось в увеличении тета- и дельта-ритмов и снижении альфа- и высокочастотных бета-ритмов. Введение животным соединения PIR-10 способствовало снижению дельта-ритма на 39,8% (p < 0,05) (FP1-A1) и 56,3% (p < 0,05) (C3-A1), тета-ритма – на 23,9% (p < 0,05) (FP1-A1) и 39,4% (p < 0,05) (C3-A1), амплитуда альфа-ритма выросла на 75,3% (p < 0,05) (C3-A1), высокочастотного бета-ритма – на 25,9% (p < 0,05) (FP1-A1) и 41,4% (p < 0,05) (C3-A1).
Выводы.
Экспериментальный дериват пиримидина PIR-10 в равной степени с кавинтоном способствовал восстановлению биоэлектрического ритма в виде понижения амплитуды дельта- и тета-ритмов и повышения амплитуды альфа- и высокочастотных бета-ритмов в лобной и теменной областях левого полушария мозга крыс.
Литература
- Воронков А.В., Шабанова Н.Б., Кодониди И.П. Влияние кавинтона и производного пиримидина PIR-4 на неврологический и сенсомоторный дефицит в условиях экспериментальной ишемии головного мозга крыс // Экспериментальная и клиническая фармакология. 2021. Т. 84, № 10. С. 10–14. DOI: 30906/0869-2092-2021-84-10-10-14.
- Луговой И.С., Кодониди И.П., Воронков А.В., Шабанова Н.Б., Кодониди М.И. Целенаправленный синтез n-пептидных производных пиримидин-4(1н)-она, обладающих церебропротекторными свойствами // Журнал научных статей «Здоровье и образование в XXI веке». 2017. Т. 19, № 8. С. 195–199.
- Назарова Л.Е., Дьякова И.Н. Влияние кислоты феруловой на зону некроза, возникающего в результате окклюзии средней мозговой артерии // Медицинский вестник Башкортостана. 2011. № 3. С.133–135.
- Трофименко А.И., Каде А.Х., Лебедев В.П., Занин С.А., Мясникова В.В. Моделирование церебральной ишемии посредством коагуляции средней мозговой артерии у крыс // Фундаментальные исследования. 2012. № 2. С. 215–218.
- Ahmed S., Meng H., Liu T., Sutton B.C et al. Ischemic stroke selectively inhibits REM sleep of rats. Experimental neurology, 2011, vol. 232, no. 2, pp. 168–175. DOI: 10.1016/j.expneurol.2011.08.020.
- Jiang S., Tian L., Ting J., Wei Y. et al. AMPK: potential therapeutic target for ischemic stroke. Theranostics, 2018, vol. 8, no. 16, pp. 4535–4551. DOI: 10.7150/thno.25674.
- Kelly K.M., Jukkola P.I., Kharlamov E.A., Downey K.L. et al. Long-term video-EEG recordings following transient unilateral middle cerebral and common carotid artery occlusion in Long–Evans rats. Experimental neurology, 2006, vol. 201, no. 2, pp. 495–506. DOI:1016/j.expneurol.2006.05.006.
- Krnjević K. Electrophysiology of cerebral ischemia. Neuropharmacology, 2008, vol. 55, no. 3, pp. 319–333. DOI: 1016/j.neuropharm.2008.01.002.
- Leemburg S., Gao B., Cam E., Sarnthein J., Bassetti C.L. Power spectrum slope is related to motor function after focal cerebral ischemia in the rat. Sleep, 2018, vol. 41, no. 10, DOI: 10.1093/sleep/zsy132.
- Wang-Fischer Y., ed. Manual of stroke models in rats. CRC Press, 2009, XIII, 332 p.
- Shabanova N.B., Gerashchenko A.D., Voronkov A.V. The effect of PIR-20 compound on cognitive deficit reduction in experimental global cerebral ischemia in rats. Archiv EuroMedica, 2021, vol. 11, no. 3, pp. 26–28. DOI: 10.35630/2199-885X/2021/11/3/7.
- Uzdensky A.B. Apoptosis regulation in the penumbra after ischemic stroke: expression of pro-and antiapoptotic proteins. Apoptosis, 2019, vol. 24, no. 9 pp. 687-702. DOI: 10.1007/s10495-019-01556-6.
- Virani S.S., Alonso A., Aparicio H.J., Benjamin E J. et al. Heart disease and stroke statistics – 2021 update: a report from the American Heart Association. Circulation, 2021, vol. 143, no. 8, pp. e254– DOI: 10.1161/CIR.0000000000000950.
Ссылка на статью
Шабанова Н.Б., Геращенко А.Д., Ефремова М.П. Влияние производного пиримидина и кавинтона на изменение биоэлектрического потенциала головного мозга в условиях фокальной церебральной ишемии крыс [Электронный ресурс] // Acta medica Eurasica. – 2023. – №1. – С. 101-107. – URL: https://acta-medica-eurasica.ru/single/2023/1/12/. DOI: 10.47026/2413-4864-2023-1-101-107.
Читать онлайн