Характеристика иммунного статуса у пациентов с декомпенсацией цирроза печени
А.Л. ИВАНОВА, Л.М. КАРЗАКОВА, А.В. ОДИНЦОВА, С.И. КУДРЯШОВ, М.В. БАГИЛЬДИНСКАЯ, Н.В. ЖУРАВЛЕВА
Ключевые слова: цирроз печени, иммунный статус, иммуноглобулины, Т-лимфоциты.
Цирроз печени продолжает оставаться острой проблемой современной медицины в связи с высокими показателями его распространенности и летальности.
Высокий уровень летальности обусловлен развитием при декомпенсированных формах цирроза печени ряда жизнеугрожающих осложнений – гепаторенального синдрома, инфекций, варикозных кровотечений.
Гепаторенальный синдром и инфекции являются следствием иммунологических сдвигов, происходящих при декомпенсации цирроза печени. Имеющиеся в настоящее временя литературные данные не позволяют создать целостной картины функционального состояния различных звеньев адаптивного иммунитета при декомпенсированном циррозе печени.
Цель исследования – изучение характерных черт адаптивного иммунитета у пациентов с декомпенсацией цирроза печени. Материал и методы.
В проспективное когортное исследование было включено 136 пациентов с декомпенсированным циррозом печени, получавших стационарное лечение в гепатологическом отделении многопрофильной больницы.
Когорта обследованных больных была разделена на две группы, одна из которых объединяла пациентов с циррозом печени вирусного происхождения (n = 78), другая – пациентов с алкогольным циррозом печени (n = 58).
Помимо общепринятых стандартных методов программа обследования пациентов включала иммунологические тесты: идентификацию Т- и В-лимфоцитов, иммунорегуляторных и активированных субпопуляций Т-лимфоцитов методом иммунофенотипирования мононуклеарных клеток периферической крови с помощью моноклональных антител. В сыворотке крови определяли уровни иммуноглобулинов IgM, IgG, IgA, циркулирующих иммунных комплексов иммунотурбидиметрическим методом.
Результаты.
Изучение показателей гуморального звена адаптивного иммунитета выявило у пациентов с декомпенсацией цирроза печени увеличение числа В-клеток, повышение IgM, IgG, IgA и циркулирующих иммунных комплексов. Клеточное звено адаптивного иммунитета отличалось увеличением относительного содержания Т-хелперных клеток, активированных Т-клеток на фоне уменьшения числа незрелых Т-клеток и Т-регуляторных клеток.
Выводы.
Отличительными чертами адаптивного иммунитета у больных с декомпенсацией цирроза печени является одновременная активация как гуморального, так и клеточного его компонентов, что, по всей видимости, поддерживает системный воспалительный процесс и связанный с ним прогрессирующий фиброз печени.
Цирроз печени (ЦП) продолжает оставаться острой проблемой современной медицины в связи с высокими показателями его распространенности и летальности.
ЦП занимает четвертую позицию в ряду основных причин смертности в Европе и ежегодно приводит к более чем миллиону смертей по всему миру [2].
Высокий уровень летальности обусловлен развитием при декомпенсированных формах ЦП ряда жизнеугрожающих осложнений – гепаторенального синдрома (ГРС), инфекций, варикозных кровотечений. ГРС и инфекции являются следствием иммунологических сдвигов, происходящих при декомпенсации ЦП. Данные литературы по изучению профиля иммунологических изменений у пациентов с осложнениями ЦП весьма противоречивы. Так, в соответствии с результатами исследований одной группы авторов спектр иммунологических изменений при ЦП включает дефицит CD4+ -Т-клеток [4, 18]. По данным других авторов, напротив, у пациентов с ЦП происходит накопление периферических и циркулирующих в крови CD4+Т-клеток [12, 25].
В ранее опубликованных работах сообщалось об обнаружении повышенных уровней сывороточных иммуноглобулинов (IgG, IgM, IgA) и циркулирующих иммунных комплексов (ЦИК) у больных ЦП [10, 13]. Однако в более поздних работах были представлены данные о повышении при ЦП уровней лишь двух классов иммуноглобулинов – IgG и IgA [7].
Имеющиеся к настоящему времени литературные данные не позволяют создать целостной картины функционального состояния различных звеньев адаптивного иммуни- тета при декомпенсированном ЦП.
Цель исследования – выявить характерные черты иммунного статуса у пациентов с декомпенсацией ЦП на основе исследования гуморального и клеточного звеньев адаптивного иммунитета.
Материал и методы исследования.
Проведено проспективное когортное исследование. В группу исследования включали пациентов с декомпенсированным ЦП, получавших стационарное лечение в гепатологическом отделении БУ «Городская клиническая больница № 1» Министерства здравоохранения Чувашии. Как правило, госпитализация больных была связана с переходом компенсированной малосимптомной стадии ЦП в декомпенсированную, проявляющуюся присоединением по крайней мере одного из следующих осложнений – варикозного кровотечения, асцита, желтухи и/или энцефалопатии.
Критериями включения служили: возраст старше 18 лет, больные ЦП, признаки декомпенсации (асцит, желтуха, варикозное кровотечение или энцефалопатия).
Критерии исключения – первичный билиарный цирроз, ЦП в исходе неалкогольной жировой болезни печени, криптогенный ЦП, аутоиммунный гепатит, тяжелая дисфункция сердечно- сосудистой системы, туберкулез, психические заболевания, онкологические заболевания, включая гепатоцеллюлярную карциному, отсутствие информированного согласия на участие в настоящем исследовании. С учетом критериев включения и исключения в исследуемую группу вошли пациенты с ЦП вирусной (гепатит В – HBV, гепатит С – HCV, гепатит D – HDV) и алкогольной этиологии.
Критериями установления вирусных гепатитов являлись: для гепатита В обнаружение HBs- антигена и ДНК HBV, гепатита С – РНК HCV, гепатита D – РНК HDV. Алкогольная этиология ЦП определялась на основании установления злоупотребления пациентами алкоголя (регулярный прием 40 г и более в день в пересчете на чистый алкоголь мужчинами и 20 г – женщинами), при этом для подтверждения употребления алкоголя использовали опросники «САGЕ» и «AUDIT» [1, 22].
Кроме того, при установлении алкогольной этиологии ЦП учитывали клинико-лабораторные «стигматы» алкоголизма: тремор рук, яркие телеангиоэктазии, отечность носа и губ, преобладание повышения в сыворотке крови уровня аспартатаминотрансферазы (АсАт) над повышением уровня аланинаминотрансферазы (АлАТ) более чем в 2 раза, повышение уровня гамма-глютамилтрансферазы (ГГТ), макроцитоз эритроцитов, повышение сывороточного уровня IgA [1].
Диагноз ЦП устанавливали с учетом биохимических изменений в сыворотке крови, результатов ультра- звукового и эластографического исследований печени.
Помимо общепринятых стандартных методов программа обследования пациентов включала иммуноло- гические тесты: идентификацию с помощью проточного лазерного цитометра Т- и В-лимфоцитов, иммунорегуляторных и активированных субпопуляций Т-лимфоцитов методом ииммунофенотипирования мононуклеарных клеток периферической крови с помощью моноклональных антител, меченных двумя или тремя различными флюоресцирующими метками (реагенты производства «Beckman Coulter», США).
При этом руководствовались методикой, предлагаемой производителем реактивов.
В сыворотке крови определяли концентрации иммуноглобулинов IgM, IgG, IgA иммунотурбидиметрическим методом с ис- пользованием автоматического биохимического анализатора DxC 700 AU («Beckman Coulter», США), исследовали содержание в сыворотке крови ЦИК иммунотурбидиметрическим методом с использованием тест-наборов реагентов «ЦИК – Хема» (ООО «Хема», Москва) на биохимическом анализаторе ILab 650 (Япония, Италия). Забор крови для выполнения иммунологических исследования проводили из локтевой вены на первый – второй дни госпитализации больных.
Показатели иммунного статуса больных ЦП сравнивали с таковыми у здоровых лиц. Демографические показатели больных и здоровых не различались между собой. Когорта обследованных больных была разделена на две группы, одна из ко- торых объединяла пациентов с ЦП вирусного происхождения (n = 78), другая – пациентов с алкогольным ЦП (n = 58). Статистическая обработка результатов была проведена с использованием программы Statistica версии 10 (CША).
Полученные в ходе исследования данные представляли в виде M±SD, где M – средняя ариф- метическая, SD – среднеквадратичное отклонение, различия показателей относительно группы здоровых лиц оценивали по критерию Стьюдента. Корреляционный анализ проводили с использованием критерия Спирмена.
Результаты исследования и их обсуждение.
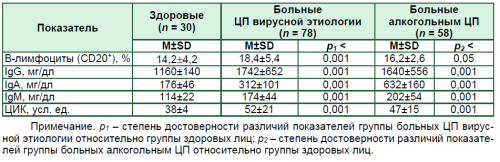
Анализ показателей гуморального звена адаптивного иммунитета у пациентов с декомпенсированным ЦП, включенных в настоящее исследование, позволил установить увеличение числа В-клеток, повышение сывороточных уровней всех исследуемых классов иммуноглобулинов и ЦИК (табл. 1).
Таблица 1
Показатели гуморального звена адаптивного иммунитета у больных ЦП
В-клетки, как известно, представляют собой классический тип лейкоцитов и основной компонент гуморального иммунитета, участвующий в адаптивном иммунном ответе и выполняют такие важные иммунологические функции, как синтез антител, презентация антигена и секреция цитокинов [9].
На примере неалкогольной жировой болезни печени ранее было показано, что в печени пациентов с ЦП наблюдается накопление В-клеток, сопровождающееся выраженным воспалением и фиброзом печени [5].
В экспериментах на модели ЦП у мышей продемонстрированы заметное увеличение количества активированных внутрипеченочных В-клеток при прогрессирующем фиброзировании печени и угнетение процесса фиброгенеза в условиях дефицита В-клеток. Также отмечается, что развитие ЦП связано с изменениями кишечной микробиоты и повышенной проницаемостью кишечника для микрофлоры.
Считается, что при этом печеночные В-клетки могут неадекватно сильно активироваться микробиотой и вызывать воспалительный процесс с повреждением клеток паренхимы печени с последующим развитием фиброза [3].
Бактериальная транслокация поддерживает неконтролируемую активацию гуморального иммунитета. Липополисахариды (ЛПС) грамотрицательных бактерий или эндотоксин усиливают системную воспалительную активность за счет активации патогенраспознающих рецепторов, в роли которых выступают Toll-подобные рецепторы (TLR), в частности TLR-2- и TLR-4.
В результате запускаются TLR-зависимые пути выработки цитокинов. Это, в свою очередь, приводит к повышенной секреции активных форм кислорода (АФК), что еще больше усиливает гиперпроницаемость кишечника и, таким образом, поддерживает порочный круг событий, широко известных как «дырявый кишечник» [24].
Содержание иммуноглобулинов в сыворотке крови поддерживается на определенном уровне В-клетками памяти и антителообразующими клетками – плазматическими клетками. Большую роль в активации В-клеток играют TLR антигенпредставляющих клеток [21]. В исследованиях in vitro показано, что В-клетки при прогрессирующем ЦП более активно реагировали на стимуляцию TLR9 трансформацией в плазматические клетки и продукцией иммуноглобулинов, приводящей к гипериммуноглобулинемии [7].
Полагают, что повышение уровней иммуноглобулинов при прогрессирующем ЦП не зависит от этиологических факторов ЦП, а связано с активацией антителопродукции за счет активации В-клеток бактериальными лигандами TLR вследствие увеличения кишечной микробной транслокации, что было подтверждено в исследованиях in vitro. [8].
Другие авторы, используя систему стимуляции цельной крови, показали, что у больных с декомпенсацией ЦП наблюдается усиленный воспалительный ответ на стимуляцию ЛПС E. coli по сравнению со здоровыми и пациентами с компенсированным ЦП [15].
Таким образом, декомпенсированный ЦП ассоциирован с активацией гуморального звена адаптивного иммунитета, обусловливающей системный воспалительный процесс в организме больных. Т-клетки представляют собой основной тип лимфоцитов в иммунной системе и играют решающую роль в адаптивном иммунном ответе.
Клон Т-клеток может распознавать антиген по наличию Т-клеточного рецептора (TCR) на его клеточной поверхности. В соответствии с дифференциальными физиологическими функциями Т-клетки можно разделить на CD8+-цитотоксические Т-клетки (Цт) и CD4+ – Т-хелперные (Tх) субпопуляции [11, 20]. Клеточное звено адап- тивного иммунитета у пациентов с ЦП отличалось увеличением процентного значения содержания Т-хелперных клеток и, соответственно, повышенным значением иммунорегуляторного индекса (Цт/Тх) (табл. 2).
Кроме того, при ЦП было увеличенным относительное содержание всех изучаемых субпопуляций активированных клеток на фоне уменьшения числа регуляторных Т-клеток (Treg-клетки) и незрелых Т-лимфоцитов.
Абсолютные значения содержания клеток общей популяции Т-лимфоцитов и их субпопуляций были меньше значений аналогичных показателей здоровых лиц, что является, по всей видимости, отражением лимфоцитопении, установленной у больных ЦП.
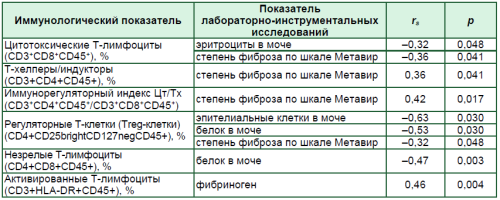
С целью изучения характера взаимосвязи иммунологических параметров со стандартными показателями лабораторных (гематологических, биохимических) и инструментальных тестов, используемых при обследовании пациентов с ЦП, был проведен корреляционный анализ, результаты которого представлены в табл. 3.
Обращает на себя внимание то, что корреляционные связи выявлены лишь у показателей клеточного звена иммунитета.
Степень фиброза, устанавливаемая при эластографическом исследовании печени, коррелировала положительно с про- центным числом Т-хелперных клеток, отрицательно – с числом цитотоксических клеток.
Treg-клетки имели обратные связи со степенью выраженности фиброза печени и с такими показателями общего анализа мочи, как уровень белка и число эпителиальных клеток. С уровнем протеинурии коррелировал отрицательно процентный показатель содержания незрелых Т-лимфоцитов.
Относительное значение содержания активированных Т-лимфоцитов, экспрессирующих антиген HLA- DR, имело прямую связь с уровнем фибриногена.
Таблица 2
Показатели клеточного звена адаптивного иммунитета у больных ЦП
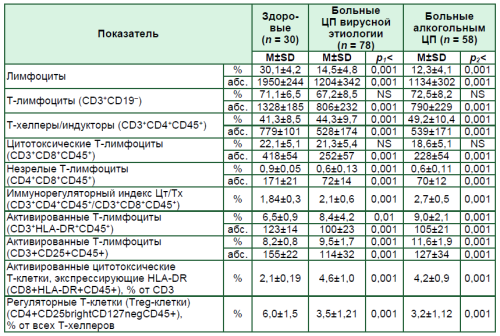
Таблица 3
Статистические значимые корреляционные связи иммунологических показателей у больных ЦП
Особого внимания заслуживают результаты изучения корреляционных взаимоотношений иммунологических показателей с осложнениями ЦП – варикозным кровотечением, печеночно-клеточной недостаточностью, острым повреждением почек (ОПП), ГРС и инфекциями (инфицированный асцит, инфек- ции мочевыводящих путей, пневмония) (табл. 4).
Таблица 4
Статистические значимые корреляционные связи иммунологических показателей с наиболее распространенными осложнениями у пациентов с ЦП
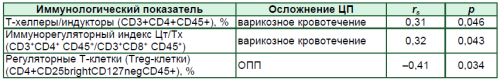
Данные, представленные в табл. 4, свидетельствуют о наличии прямой связи между показателями относительного содержания Т-хелперных клеток, иммунорегуляторного индекса, с одной стороны, и риском развития кровотечений из варикозно расширенных вен пищевода и желудка – с другой.
Число Treg-клеток коррелировало отрицательно с риском развития ОПП.
Таким образом, результаты исследования иммунного статуса у пациентов с декомпенсацией ЦП свидетельствуют об активации как гуморального, так и клеточного звеньев адаптивного иммунитета. При этом не обнаружено существенных различий в характере изменений адаптивного иммунитета в зависимости от этиологии ЦП.
Показатели клеточного компонента адаптивного иммунитета проявляли корреляционные связи с рядом патогенетически значимых параметров ЦП и жизнеугрожающих осложнений, развивающихся при ЦП. Так, относительное значение содержания Т-хелперных клеток и иммунорегуляторный индекс, которые были увеличены у больных ЦП, имели прямую связь со степенью фиброза по шкале Метавир.
Как известно, фиброз является основным патогенетическим механизмом развития ЦП в ответ на повреждение паренхимы печени этиологическими факторами данного заболевания (вирусы, алкоголь, токсические химические соединения) и постоянную активацию воспалительной реакции.
Фиброгенез печени – это динамичный, высокоинтегрированный молекулярный, клеточный и тканевой процесс, ответственный за избыточное накопление компонентов внеклеточного матрикса, обеспечиваемое печеночными миофибробластами [16, 19].
В экспериментах на животных показано, что Т-хелперы (CD3+CD4+CD45+) оказывают фиброгенное действие на ткани печени за счет продукции провоспалительного цитокина интерферона-гамма (IFN-γ) [23]. В условиях дефицита IFN-γ у животных (мыши), содержавшихся на пищевом рационе с высоким содержанием жиров, угнеталось развитие стеатогепатита и уменьшалось фиброзирование печени [17].
В совокупности эти данные демонстрируют, что Т-хелперные клетки оказывают при развитии ЦП провоспалительное и профибротическое действие, вероятно, связанное с продукцией провоспалительного цитокина – IFN-γ.
Уменьшение числа Treg-клеток, установленное при ЦП, коррелировало отрицательно с числом эпителиальных клеток и выраженностью протеинурии, что косвенно свидетельствует о значимости уменьшения клеток данной популяции Т-лимфоцитов в развитии патологии почек при ЦП.
Действительно, корреляционный анализ показал, что уменьшение числа Treg-клеток повышает риск развития ОПП.
Известно, что Treg-клетки продуцируют иммуносупрессив- ные цитокины – трансформирующий фактор роста бета (TGF-β) и интерелейкин-10 (IL-10) [6]. Кроме того уменьшение числа Treg-клеток может оказывать профиброгенное влияние на печень, свидетельством чему является наличие обратной связи между числом данных клеток и степенью фиброза печени.
К тому же и данные литературы свидетельствуют о том, что Treg-клетки оказывают антифиброгенное действие благодаря секреции противовоспалительного и иммуносупрессирующего цитокина – IL-10 [26]. В эксперименте на лабораторных животных было показано, что перевязка желчных протоков и истощение Treg-клеток усугубляют фиброгенез печени [14].
Выводы.
Результаты настоящего исследования позволили дать комплекс- ную характеристику состоянию адаптивного звена иммунитета у пациентов с декомпенсированным ЦП.
Как гуморальный, так и клеточный компоненты адаптивного иммунного ответа при ЦП находятся в активированном состоянии, что, по всей видимости, поддерживает системный воспалительный процесс и связанный с ним прогрессирующий фиброгенез печени у пациентов с данной патологией.
Преобладающим в механизмах фиброгенеза печени является вклад активизации Т-клеточного звена иммунитета на фоне дефицита Treg-клеток.
Увеличение относительного содержания числа CD4+— Т-клеток, установленное при декомпенсации ЦП, связано с увеличением риска развития варикозных кровотечений, в то время как уменьшение процентного числа другой популяции Т-лимфоцитов – Treg- клеток повышает угрозу другого жизнеугрожающего осложнения – ОПП.
Литература
- Алкогольная болезнь печени (АБП) у взрослых / Л.Б. Лазебник, Е.В. Голованова, Е.Ю. Ере- мина и др. // Экспериментальная и клиническая гастроэнтерология. Т. 174. С. 4–28. DOI: 10.31146/1682-8658-ecg-174-2-4-28.
- Asrani K., Devarbhavi H., Eaton J. et al. Burden of liver diseases in the world. J Hepatol, 2019, vol. 70, no. 1, pp. 151–171. DOI: 10.1016/j.jhep.2018.09.014.
- Barrow F., Khan S., Fredrickson G. et al. Microbiota-driven activation of intrahepatic b cells ag- gravates NASH through innate and adaptive signaling. Hepatology, 2021, vol. 74, pp. 704–722. DOI: 1002/hep.31755.
- Basho K., Zoldan K., Schultheiss M. et al. IL-2 contributes to cirrhosis-associated immune dys- function by impairing follicular T helper cells in advanced J Hepatol, 2021, vol. 74, no. 3, pp. 649–660. DOI:10.1016/j.jhep.2020.10.012.
- Bruzzì , Sutti S., Giudici G. et al. B2-lymphocyte responses to oxidative stress-derived antigens contribute to the evolution of nonalcoholic fatty liver disease (NAFLD). Free Radic Biol Med, 2018, vol. 124, pp. 249–259. DOI: 10.1016/j.freeradbiomed.2018.06.015.
- Chapel , Haeney M., Misbah S. et al. Essentials of clinical immunology. Wiley Blackwell, 2014, vol. 6, pp. 3–24.
- Doi H., Hayashi E., Arai J. et al. Enhanced B-cell differentiation driven by advanced cirrhosis resulting in J Gastroenterol Hepatol, 2018, Feb. 10. DOI: 10.1111/jgh.14123.
- Doi H., Iyer T.K., Carpenter E. et al. Dysfunctional B-cell activation in cirrhosis resulting from hepatitis C infection associated with disappearance of CD27-positive B-cell Hepatol- ogy, 2012, vol. 55, pp. 709–719. DOI: 10.1002/hep.24689.
- Fillatreau S. B cells and their cytokine activities implications in human diseases. Clin Immunol, 2018, 186, pp. 26–31. DOI: 10.1016/j.clim.2017.07.020.
- Gluud , Tage-Jensen U., Rubinstein E., Henriksen J.H. Autoantibodies and immunoglobulins in patients with alcoholic cirrhosis. Relation to measurements of hepatic function and hemodynamics. Di- gestion, 1984, vol. 30, no. 1, pp. 1-6. DOI: 10.1159/000199084.
- Godfrey I., Uldrich A.P., McCluskey J. et al. The burgeoning family of unconventional T cells. Nat Immunol, 2015, vol. 16, pp. 1114–1123. DOI: 10.1038/ni.3298.
- Her , Tan J.H.L., Lim Y.S. et al. CD4 + T cells mediate the development of liver fibrosis in high fat diet-induced NAFLD in humanized mice. Front Immunol, 2020, vol. 11, p. 580968. DOI: 10.3389/fimmu.2020.580968.
- Joshi N., Ayesha Q., Habibullah C.M. Immunological studies in HBV-related chronic liver dis- Indian J Pathol Microbiol, 1990, vol. 33, no. 4, pp. 351–354.
- Katz S.C., Ryan K., Ahmed N. et al. Obstructive jaundice expands intrahepatic regulatory T cells, which impair liver T lymphocyte function but modulate liver cholestasis and fibrosis. J Immunol, 2011, 187, pp. 1150–1156. DOI: 4049/jimmunol.1004077.
- Kronsten T., Woodhouse C.A., Zamalloa A. et al. Exaggerated inflammatory response to bac- terial products in decompensated cirrhotic patients is orchestrated by interferons IL-6 and IL-8. Am J Physiol Gastrointest Liver Physiol, 2022, vol. 322, no. 5, pp. G489–G499. DOI:10.1152/ajpgi.00012.2022.
- Lackner , Tiniakos D. Fibrosis and alcohol-related liver disease. J Hepatol, 2019, vol. 70, no. 2, pp. 294–304. DOI:10.1016/j.jhep.2018.12.003.
- Luo X.Y., Takahara T., Kawai K. et al. IFN-γ deficiency attenuates hepatic inflammation and fibrosis in a steatohepatitis model induced by a methionine- and choline-deficient high-fat Am J Phys- iol Gastrointest Liver Physiol, 2013, vol. 305, pp. G891–899. DOI: 10.1152/ajpgi.00193.2013.
- McGovern H., Golan Y., Lopez M. et al. The impact of cirrhosis on CD4+ T cell counts in HIV- seronegative patients. Clinical Infectious Diseases, 2007, vol. 44, no. 3, pp. 431–437. DOI: 10.1086/509580.
- Parola M., Pinzani M. Liver fibrosis: Pathophysiology, pathogenetic targets and clinical is- Mol Aspects Med. 2019, vol. 65, pp. 37–55. DOI:10.1016/j.mam.2018.09.002.
- Pennington D.J., Vermijlen D., Wise E.L. et al. The integration of conventional and unconven- tional T cells that characterizes cell-mediated responses. Adv Immunol, 2005, vol. 87, pp. 27–59. DOI: 1016/S0065-2776(05)87002-6.
- Pone E.J., Zan H., Zhang J. et al. Toll-like receptors and B-cell receptors synergize to induce immunoglobulin class-switch DNA recombination: relevance to microbial antibody responses. Rev. Immunol, 2010, vol. 30, pp. 1–29. DOI: 10.1615/critrevimmunol.v30.i1.10.
- Reinert D.F., Allen J.P. The Alcohol Use Disorders Identification Test (AUDIT): a review of re- cent Alcohol Clin Exp Res, 2002, vol. 26, no. 2, pp. 272–279.
- Rolla S., Alchera E., Imarisio C. et al. The balance between IL-17 and IL-22 produced by liver- infiltrating T-helper cells critically controls NASH development in mice. Clin Sci (Lond), 2016, vol. 130, 193–203. DOI: 10.1042/CS20150405.
- Strnad , Tacke F., Koch A., Trautwein C. Liver – guardian, modifier and target of sepsis. Nature Reviews. Gastroenterology & Hepatology, 2017, vol. 14, no. 1, pp. 55–66. DOI: 10.1038/nrgastro.2016.168.
- Sutti S., Albano E. Adaptive immunity: an emerging player in the progression of NAFLD. Nat Rev Gastroenterol Hepatol, 2020, 17, pp. 81–92. DOI: 10.1038/s41575-019-0210-2.
- Zhang C., Li L., Feng K. et al. ‘Repair’ treg cells in tissue injury. Cell Physiol Biochem, 2017, 43, pp. 2155–2169. DOI: 10.1159/000484295.
Источник:Медицинский вестник Евразии
Иванова А.Л., Карзакова Л.М., Одинцова А.В., Кудряшов С.И., Багиль— динская М.В., Журавлева Н.В. Характеристика иммунного статуса у пациентов с декомпенсацией цирроза печени [Электронный ресурс] // Acta medica Eurasica. – 2023. – № 1. – С. 53–62. – URL: http://acta-medica-eurasica.ru/single/2023/1/7. DOI: 10.47026/2413-4864-2023-1-53-62.